Thêm 3 loại vaccine mới được cấp phép, gia hạn lưu hành tại Việt Nam
Theo quyết định số 308/QĐ-QLD, danh mục 40 vaccine, sinh phẩm được cấp, gia hạn giấy đăng ký lưu hành tại Việt Nam (Đợt 50), bao gồm: 22 vaccine và 1 sinh phẩm (có hiệu lực 5 năm); 8 vaccine, sinh phẩm (hiệu lực 3 năm) và 9 sinh phẩm được gia hạn giấy đăng ký lưu hành hiệu lực 3 năm.
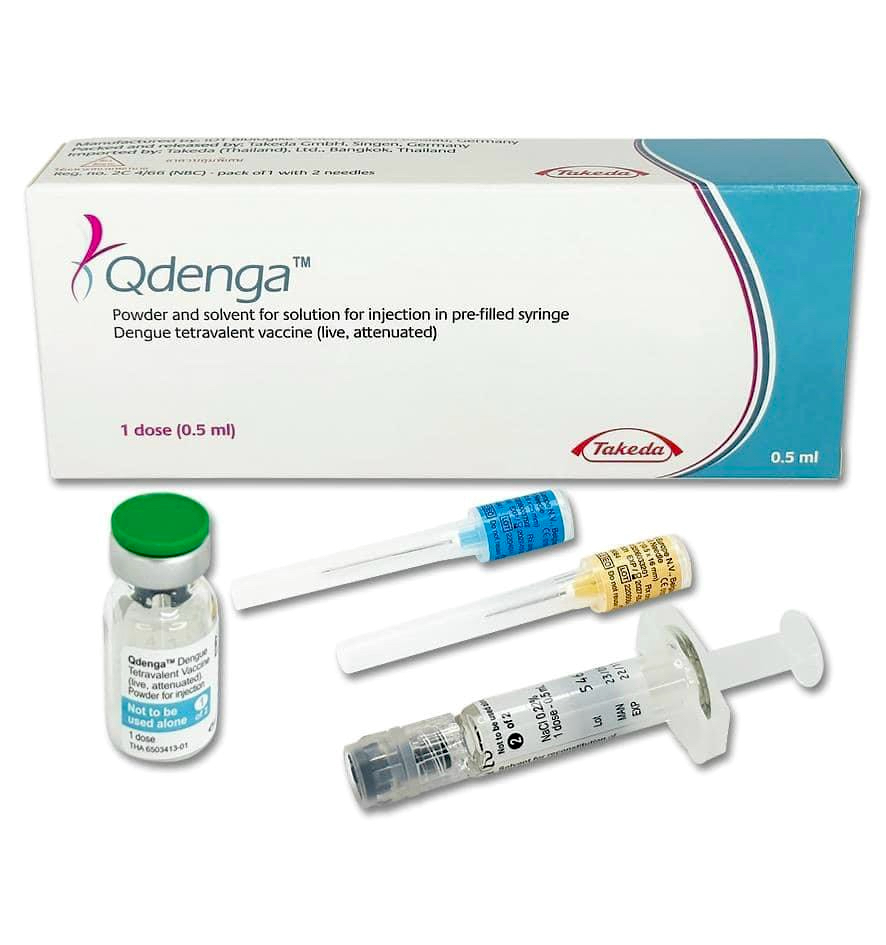
Trong đợt 50 này, có 3 loại vaccine mới vừa được cấp phép, gia hạn lưu hành, gồm: vaccine Qdenga phòng bệnh sốt xuất huyết, vaccine Shingrix phòng bệnh zona thần kinh và vaccine Pneumovax 23 thế hệ mới phòng 23 chủng phế cầu khuẩn. Cả 3 vaccine mới này đều được sản xuất bởi các hãng dược phẩm lớn trên thế giới là Takeda (Nhật Bản), GSK (Bỉ) và MSD (Mỹ) và đã được sử dụng tại nhiều quốc gia trên thế giới.
Trước đó, Bộ Y tế, Hội đồng cấp phép cũng đã xem xét đánh giá về độ an toàn và tính hiệu quả của các loại vaccine này trước khi được vào sử dụng tại Việt Nam.
Theo đó, vaccine Qdenga phòng sốt xuất huyết do hãng dược phẩm Takeda sản xuất, có hiệu lực bảo vệ hơn 80% và chống lại cả 4 nhóm huyết thanh virus sốt xuất huyết, dành cho trẻ từ 4 tuổi trở lên, với lịch tiêm 2 mũi cách nhau 3 tháng.

Vaccine Shingrix (GSK- Bỉ) phòng bệnh zona thần kinh, có hiệu lực trên 97%, tiêm 2 mũi, cách nhau 2- 6 tháng, dành cho người từ 50 tuổi trở lên với sức khỏe bình thường hoặc cho người từ 18 tuổi trở lên có nguy cơ cao mắc zona, do có tình trạng suy giảm miễn dịch. Vaccine Pneumovax 23 do hãng dược MSD (Mỹ) sản xuất, có hiệu lực bảo vệ hơn 90%, dành cho trẻ từ 2 tuổi và người lớn với lịch tiêm 1 mũi.
Dự kiến, vaccine phòng sốt xuất huyết sẽ có mặt tại một số trung tâm tiêm chủng trên địa bàn tỉnh Tây Ninh vào quý IV năm 2024.
Tâm Giang
Tác giả: Nhân Phụng (tổng hợp)
Nguồn tin: baotayninh.vn
Ý kiến bạn đọc
- Đang truy cập19
- Máy chủ tìm kiếm4
- Khách viếng thăm15
- Hôm nay2,935
- Tháng hiện tại17,012
- Tổng lượt truy cập5,026,219